I. LỜI MỞ
Ở Việt Nam chúng ta, nhiều bệnh nhân, đặc biệt người bị ung thư, được giới thiệu cấc loại thực phẩm chức năng, thuốc chưa qua các thử nghiệm lâm sàng với những quảng cáo “có cánh”. Vì thế, đã có người “tiền mất, tật mang” mất “thời gian vàng” để chữa bệnh, thậm chí làm bệnh nặng thêm hoặc tử vong.
Bài viết thông tin về quy trình chuẩn phát triển, lưu hành một loại thuốc chữa bệnh cho con người.
II. QUY TRÌNH PHÁT TRIỂN THUỐC CHUẨN
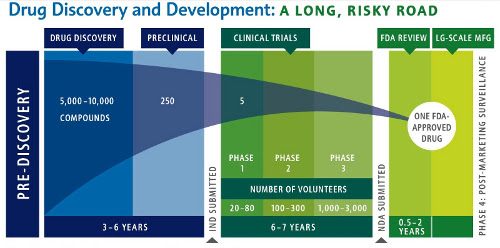
Một loại thuốc mới, từ khi khám phá, phát triển và đưa dược ra thị trường là một con đường dài, gian nan, phức tạp. Các nhà nghiên cứu tính toán, để phát triển một loại thuốc mới từ giai đoạn phát hiện cho tới khi đưa vào điều trị, trung bình phải từ 5 đến 10 ngàn hợp chất mới có 1 được chấp thuận, trong thời gian 10-15 năm, với chi phí từ 800 triệu tới 1 tỷ USD
Quy trình phát triển thuốc mới thường qua 8 bước sau:
1. Xác định mục tiêu, đích tác dụng của thuốc.
2. Đánh giá mục tiêu cụ thể.
3. Tìm kiếm thuốc, phân tử tiềm năng.
4. Thử nghiệm tiền lâm sàng trong phòng lab và trên động vật.
Sau khi sản xuất, thuốc mới phải trải qua quá trình điều tra cẩn thận trong phòng thí nghiệm, sau đó là thử nghiệm tiền lâm sàng trên động vật.
5. Thử nghiệm lâm sàng
Sau thử nghiệm tiền lâm sàng có kết quả tốt, thuốc mới được đưa vào thử nghiệm lâm sàng, trực tiếp trên cơ thể con người qua 3 giai đoạn:
* Thử nghiệm lâm sàng pha 1 Với một nhóm nhỏ người tình nguyện khỏe mạnh (20 – 100 người). Mục đích chính là kiểm tra các thông số dược động học, dược lý học, và tính an toàn trên người của thuốc.
* Thử nghiệm lâm sàng pha 2 Trên một nhóm nhỏ bệnh nhân (100 – 500 người) để xem tác dụng chính, tác dụng phụ bất lợi và các rủi ro của thuốc.
* Thử nghiệm lâm sàng pha 3 Trên một nhóm lớn bệnh nhân (1,000 – 5,000 người) để đưa ra được các dữ liệu thống kê có ý nghĩa về độ an toàn, tác dụng và mối quan hệ giữa lợi ích và nguy cơ của thuốc. Thử nghiệm pha 3 dài và tốn kém nhất. Thường phải tiến hành tại nhiều trung tâm, quốc gia, vùng lãnh thổ khác nhau trên thế giới, để thu thập đầy đủ các dữ liệu nhằm kết luận xem thuốc có tác dụng và hiệu quả hay là không.
6. Đăng ký thuốc mới và xin các cơ quan quản lý dược cấp phép
Hồ sơ thuốc mới chứa tất cả thông tin nghiên cứu từ những năm trước, cũng như kế hoạch sản xuất, và nhãn sản phẩm.
Cơ quan quản lý sẽ kiểm tra về mặt chuyên môn tất cả các thông tin có trong Hồ sơ đăng ký thuốc mới để xác định rằng loại thuốc đó có đủ an toàn và hiệu quả để chấp thuận hay không.
7. Sản xuất
Dù đã được cấp phép, thuốc mới vẫn tiếp tục được thử nghiệm lâm sàng pha 4. Vì số bệnh nhân sử dụng thuốc rất lớn, các công ty dược phẩm cần thử nghiệm tiếp để đánh giá về độ an toàn, ảnh hưởng lâu dài của thuốc với các bệnh nhân, và gửi báo cáo định kỳ, bao gồm cả các trường hợp gặp phải phản ứng bất lợi cho cơ quan quản lý dược. Hơn nữa, các cơ quan quản lý thỉnh thoảng cũng yêu cầu các công ty phải cung cấp thêm nghiên cứu trong thử nghiệm pha 4 trong quyết định cấp phép của mình.
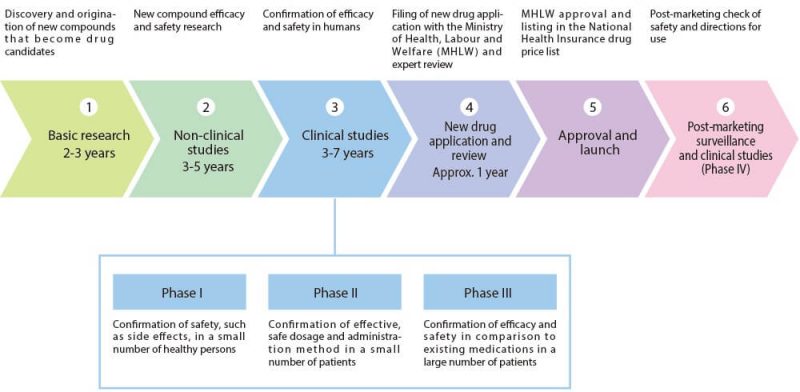
8. Hậu kiểm
Sau khi ra thị trường, thuốc mới này tiếp tục được theo dõi ở các cấp độ khác nhau để đánh giá tính an toàn và hiệu quả của nó chặt chẽ và thực tế. Việc theo dõi, đánh giá lâu dài, liên tục cũng là một điều kiện do các cơ quan quản lý cập nhật hiệu quả và cho phép sử dụng thuốc rộng rãi hơn so với đánh giá đầu tiên.
III. THAY LỜI KẾT
Ở mọi quốc gia trên thế giới. quá trình phê duyệt thuốc được kiểm soát hết sức chặt chẽ bởi các cơ quan quản lý của chính phủ.
Thống kê y dược học cho thấy, thường chỉ có 5/5000 thuốc tiến hành thử nghiệm tiền lâm sàng được thử nghiệm lâm sàng trên người. Và chỉ 1 trong 5 thuốc được thử nghiệm lâm sàng trên người được phê duyệt. Dù chưa xác định được thời gian tiêu biểu cần thiết để thử nghiệm và phê duyệt một loại thuốc mới, các nhà khoa học ước tính phải mất từ 10 đến 15 năm hoặc hơn để hoàn thành cả 3 giai đoạn thử nghiệm lâm sàng trước khi thuốc được cấp phép, với chi phí trung bình khoảng 2,6 tỷ đô la.
Ở Việt Nam chúng ta, các phác đồ điều trị được xây dựng dựa trên việc lựa chọn, áp dụng kinh nghiệm từ nhiều quốc gia, đặc biệt từ khuyến cáo của Tổ chức Y tế Thế giới WHO. Kết quả điều trị theo phác đồ được Bộ Y tế phê duyệt trước nay tương đố có hiệu quả.
Theo tôi, y khoa là ngành khoa học cần chứng cứ (evidence based science) và sức khỏe, tính mạng con người là quý giá nhất. Do đó, chúng ta chỉ nên sử dụng các loại thuốc, vaccine đựợc phát triển theo đúng quy trình khoa học nêu trên đây.
IV. TÀI LIỆU THAM KHẢO
[1] Drug discovery
https://en.wikipedia.org/wiki/Drug_discovery
[2] The Drug Development Process
https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process
[3] Drug discovery and development
http://www.astp4kt.eu/downloads/BPL/Drug_Discovery_and_Development.pdf
[4] Drug discovery and development
https://www.fda.gov/patients/drug-development-process/step-1-discovery-and-development
[5] Overall Drug Discovery and Development Process
http://www.nationalacademies.org/hmd/~/media/50A4427DD41143F5A7CE5ACDD22B0107.ashx
[6] Drug discovery and development: Role of basic biological research
https://www.sciencedirect.com/science/article/pii/S2352873717300653
[7] Drug discovery and development
https://www.britannica.com/technology/pharmaceutical-industry/Drug-discovery-and-development
[8] How long a new drug takes to go through clinical trials
[9] Drug approvals-From invention to market-A 12 years trip
https://www.medicinenet.com/script/main/art.asp?articlekey=9877
[10] Drug development: the journey of a medicine from lab to shelf
[11] How long does it usually take to go from discovery to consumer production for pharmaceutical drugs?
[12] How long does the FDA take to approve a drug?
https://www.hiv.va.gov/patient/clinical-trials/drug-approval-process.asp
[13] The Drug Development Process
[14] Drug discovery and development process
[15] The Drug Discovery Process
TS.BS Trần Bá Thoại
Ủy viên BCH Hội NỘI TIẾT VIỆT NAM
 SĐT:
SĐT: 
